Anwendung
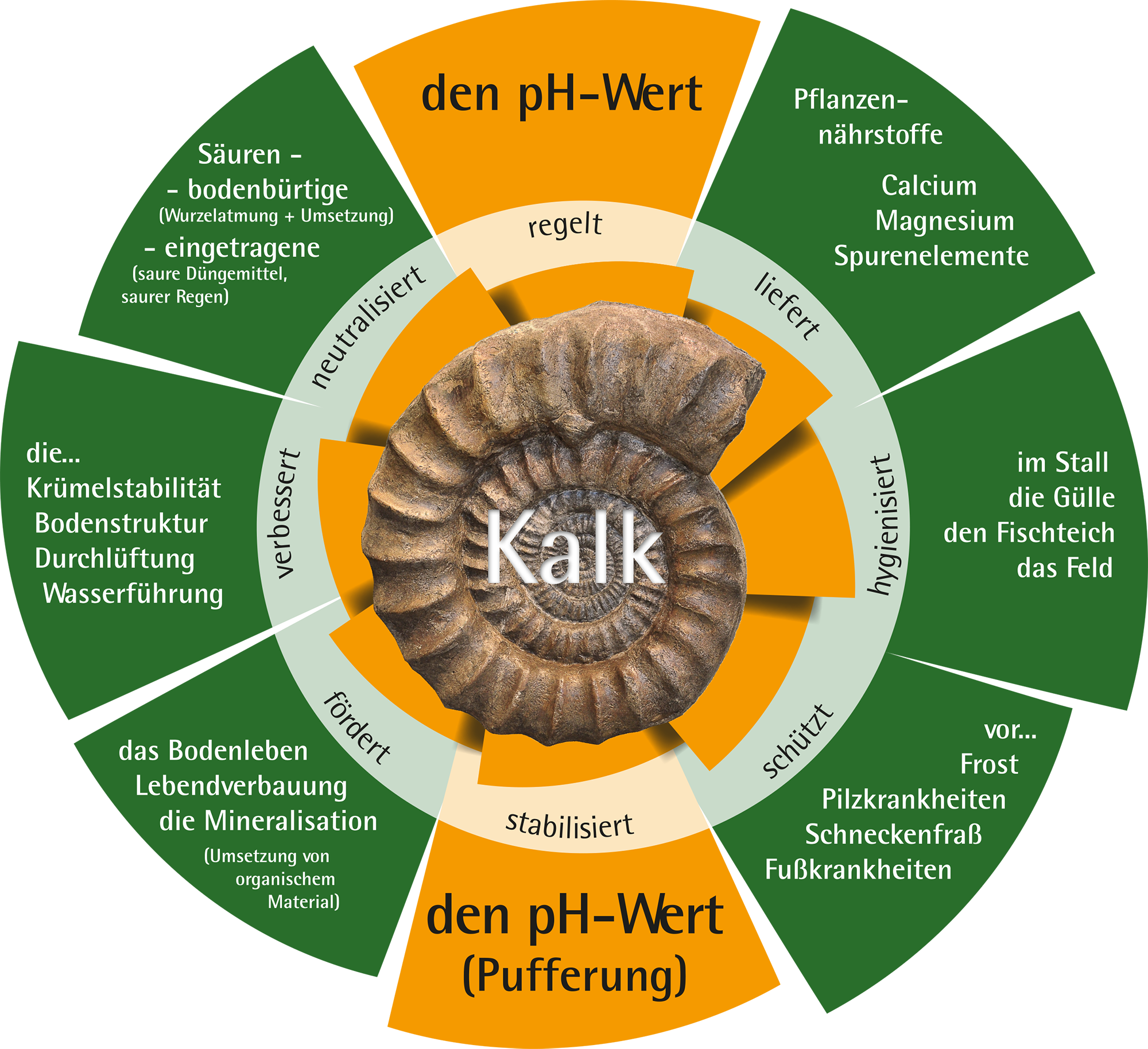
Die Wirkung der Kalkung auf den Boden war schon den Römern bekannt. Kalk schafft durch seine vielfältigen nützlichen Eigenschaften die Voraussetzung für einen gesunden Boden. Abhängig von der Bodenart und der geplanten Fruchtfolge ist die regelmäßige Kalkung notwendig um hohe Erträge zu erzielen.
Der günstige Einfluss von Kalk auf das Bodengefüge im Sinne der Porenwinkelvermörtelung von Tonteilchen und die damit verbundene positive Wirkung auf den Luft-, Wasser- und Wärmehaushalt sind besonders für das Bodenleben (Regenwürmer etc.) und das frühe Wurzelwachstum äußerst wichtig. Kalk ist Bodendünger und Pflanzennährstoff zugleich.
Darüber hinaus wird Kalk seit einigen Jahren erfolgreich in der Stallhygiene eingesetzt. Die Kalk-Stroh-Matratze ist im modernen Milchviehstall kaum wegzudenken!

Wie puffert Kalk im Boden? OH + H = Wasser pH 7
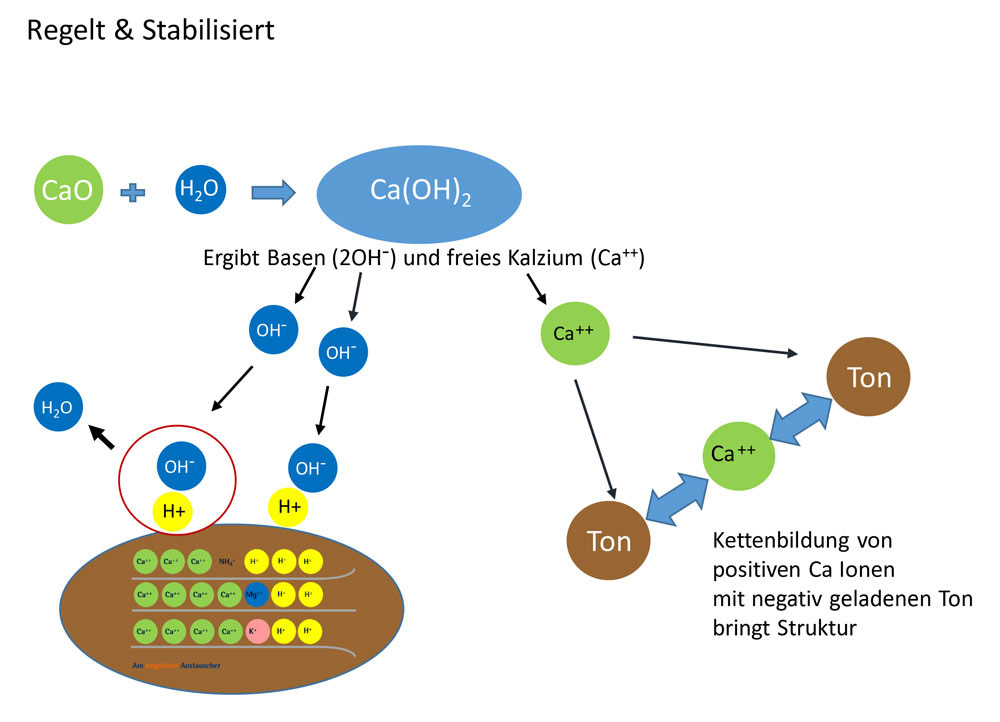
Kalk kommt von Natur aus als Gestein in vielen Böden vor. Kalk besteht aus Calciumcarbonat (CaCO3) und teilweise aus Magnesiumcarbonat (MgCO3). Ist der MgCO3 Gehalt > als 15 % wird der Kalk als dolomitisch bzw. bei > 30 % als Dolomit bezeichnet. Bei der Lösung der chemischen Bindung des Carbonats liefert der Kalk einerseits die Hydrogen-Ionen bzw. Basen (OH-), welche Bodensäuren (H+) abpuffern und andererseits Calcium-Ionen (Ca++). Die Ca++-Ionen spielen bei der Pufferung und Säureneutralisation keine Rolle, sind jedoch wesentlich, um die Bodenstruktur zu verbessern (Tonflockung) und zu stabilisieren.
Im Detail läuft die Reaktion vom Kalk zu den Basen (OH-) über mehrere Stufen ab: Von Natur aus wird das Calciumcarbonat (CaCO3) im Boden durch Kohlensäure aufgelöst. Die Kohlensäure (H2CO3) entsteht in der Bodenluft aus Wasser und Kohlendioxid (CO2), welches Bodenlebewesen und Pflanzenwurzeln bei ihrer Atmung und Umsetzung von organischer Substanz im Boden bilden.
Je aktiver das Bodenleben, desto stärker ist die CO2-Bildung, desto mehr Kohlensäure (H2CO3) fällt an. Diese löst das CaCO3 zu Calciumdihydrogencarbonat Ca(HCO3)2, man spricht von der sog. Carbonatverwitterung.
Aus dem Ca(HCO3)2 entsteht dann in Verbindung mit Wasser das lösliche Calciumhydroxid Ca(OH)2. Erst das Ca(OH)2 bzw. die frei werdenden Hydrogen-Ionen (OH-) puffern die Bodensäuren (H+), wobei neutrales Wasser entsteht. Bei einer Kalkung mit Branntkalk (CaO) entsteht in Verbindung mit Wasser sofort das Ca(OH)2, welches auch als Kalkhydrat, Kalkmilch oder Kalklauge bezeichnet wird.
Kalk wirkt als Puffersystem für Säuren, die vom Menschen verursacht aber auch natürlich in den Boden gelangen, z. B. mit Niederschlägen: Regenwasser ist mit einem durchschnittlichen pH von 5,6 schwach sauer, u. a. durch Verbrennungsabgase von Autos und Fabriken sowie Kohlensäure aus der Atmosphäre (saurer Regen = pH 4). Weitere Säureeinträge können aus übermäßiger Düngung und Abbau von organischem Material stammen. Die Kalkpufferung ist von zentraler Bedeutung für einen stabilen Boden-pH.
Ist der Boden von Natur aus kalkarm oder werden Kalkverluste nicht über Kalkungen ausgeglichen,
versauert die Kohlensäure, die von den Bodenlebewesen produziert wird, den Boden. Der pH-Wert im Boden sinkt ab. Erhöht sich hingegen die Konzentration an OH--Ionen, z. B. nach einer stärkeren Kalkung, werden H+-Ionen neutralisiert (zu H2O), der Boden-pH steigt an.

Calcium und Magnesium liefert essentielle Pflanzennährstoffe
Calcium wird in Abhängigkeit vom Ca-Gehalt in der Bodenlösung und dem pH-Wert im Boden ausschließlich als Ca++ Ion aufgenommen und kann bei Bedarf mit dem Transpirationsstrom im Xylem in die oberirdischen Pflanzenteile verlagert werden. Eine Rückverlagerung des Ca++ aus älteren Blättern in jüngere Pflanzenteile oder in die Wurzeln ist dagegen nicht möglich. Ein Ca-Mangel kann zu einem völligen Zusammenbruch des Gewebes führen.
Magnesium (Mg++) wird im Allgemeinen von der Pflanze in geringeren Mengen aufgenommen als Calcium (Ca++) Ionenkonkurrenz mit verschiedenen Kationen kann die Aufnahme beeinträchtigen. In der Pflanze selbst ist hingegen das Magnesium (Mg++) recht gut beweglich, wodurch es sich grundsätzlich vom Ca++ unterscheidet. Die gute Verlagerung in oberirdische Pflanzenteile ist auch der Grund, dass Mg++ bei nicht ausreichender Versorgung aus älteren Blättern in jüngere Blätter transportiert wird.

Stallhygiene

Noch vor wenigen Jahrzehnten war Kalklauge das gebräuchlichste Desinfektionsmittel. Die Wirkung beruht auf dem über 12 liegenden pH-Wert. Bakterien, Viren und Pilze sterben bei so hohen pH-Werten ab. Kalklauge wird durch löschen von Branntkalk mit Wasser hergestellt.
Branntkalk bzw. Magnesiumbranntkalk wird durch Erhitzen von Kalkstein oder Dolomitstein bei ca. 1.000 °C entsäuert.
Magnesiumbranntkalk erreicht ähnlich hohe pH-Werte wie Branntkalk. Beim Löschen allerdings kommt es zu geringeren Temperaturen und er ist hautverträglicher.
Dolomitmehl – mikrofein vermahlen erreicht pH-Werte von ca. 8 pH und verbessert durch die Alkalität den Hygienestandard im Stall und fördert das Wohlergehen der Tiere.
Werkseitige Mischungen von Magnesiumbranntkalk und Dolomitmehl erzielen auch gute Ergebnisse und finden Anwendung.

Einsatz zur Hygiene
Da durch Kalk der Boden besser abtrocknet und Schnecken Feuchtigkeit benötigen.
Der weiße Kalkanstrich im Herbst sorgt für bessere Reflektion der Sonnenstrahlen
und sorgt für geringere Spannungsdifferenzen und schützt vor Verletzungen der
Rinde.

Stabilisiert

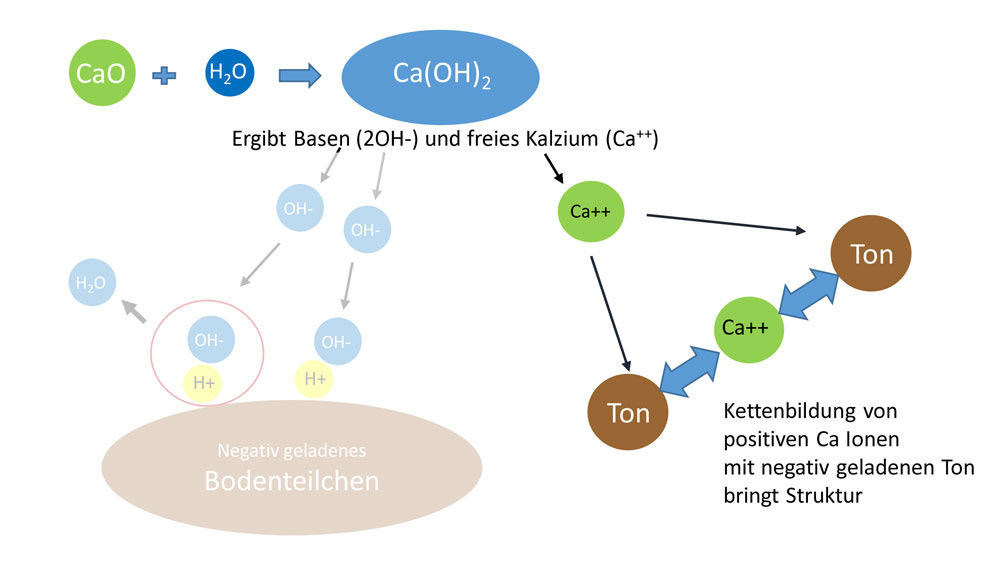
Kalk kommt von Natur aus als Gestein in vielen Böden vor. Kalk besteht aus Calciumcarbonat (CaCO3) und teilweise aus Magnesiumcarbonat (MgCO3). Ist der MgCO3 Gehalt > als 15 % wird der Kalk als dolomitisch bzw. bei > 30 % als Dolomit bezeichnet. Bei der Lösung der chemischen Bindung des Carbonats liefert der Kalk einerseits die Hydrogen-Ionen bzw. Basen (OH-), welche Bodensäuren (H+) abpuffern und andererseits Calcium-Ionen (Ca++). Die Ca++-Ionen spielen bei der Pufferung und Säureneutralisation keine Rolle, sind jedoch wesentlich, um die Bodenstruktur zu verbessern (Tonflockung) und zu stabilisieren.
Im Detail läuft die Reaktion vom Kalk zu den Basen (OH-) über mehrere Stufen ab: Von Natur aus wird das Calciumcarbonat (CaCO3) im Boden durch Kohlensäure aufgelöst. Die Kohlensäure (H2CO3) entsteht in der Bodenluft aus Wasser und Kohlendioxid (CO2), welche Bodenlebewesen und Pflanzenwurzeln bei ihrer Atmung und Umsetzung von organischer Substanz im Boden bilden.
Je aktiver das Bodenleben, desto stärker ist die CO2-Bildung, desto mehr Kohlensäure (H2CO3) fällt an. Diese löst das CaCO3 zu Calciumdihydrogencarbonat Ca(HCO3)2, man spricht von der sog. Carbonatverwitterung.
Aus dem Ca(HCO3)2 entsteht dann in Verbindung mit Wasser das lösliche Calciumhydroxid Ca(OH)2. Erst das Ca(OH)2 bzw. die frei werdenden Hydrogen-Ionen (OH-) puffern die Bodensäuren (H+), wobei neutrales Wasser entsteht. Bei einer Kalkung mit Branntkalk (CaO) entsteht in Verbindung mit Wasser sofort das Ca(OH)2, welches auch als Kalkhydrat, Kalkmilch oder Kalklauge bezeichnet wird.
Kalk wirkt als Puffersystem für Säuren, die vom Menschen verursacht aber auch natürlich in den Boden gelangen, z. B. mit Niederschlägen: Regenwasser ist mit einem durchschnittlichen pH von 5,6 schwach sauer, u. a. durch Verbrennungsabgase von Autos und Fabriken sowie Kohlensäure aus der Atmosphäre (saurer Regen = pH 4). Weitere Säureeinträge können aus übermäßiger Düngung und Abbau von organischem Material stammen. Die Kalkpufferung ist von zentraler Bedeutung für einen stabilen Boden-pH.
Ist der Boden von Natur aus kalkarm oder werden Kalkverluste nicht über Kalkungen ausgeglichen,
versauert die Kohlensäure, die von den Bodenlebewesen produziert wird, den Boden. Der pH-Wert im Boden sinkt ab. Erhöht sich hingegen die Konzentration an OH--Ionen, z. B. nach einer stärkeren Kalkung, werden H+-Ionen neutralisiert (zu H2O), der Boden-pH steigt an.

Kalkung fördert das Bodenleben

Kalk fördert die biologischen Umsetzungsprozesse im Boden. Die gesteigerte mikrobielle Tätigkeit führt u. a. zu einer besseren Vernetzung und Verklebung der Bodenkolloide, was sich positiv auf die Stabilität der Bodenkrümel auswirkt.
Nur in einem Boden, der gut mit Kalk versorgt ist, findet das Bodenleben optimale Lebensbedingungen. Dort kann es sich rasch vermehren und die organische Substanz in wertvollen Dauerhumus umbauen. Auf versauerten Böden ist dagegen die Mikrobentätigkeit deutlich reduziert. Dies kann dazu führen, dass sowohl die Strohrotte als auch der Abbau organischer Dünger gehemmt werden.
Ebenso sind Mulchsaatverfahren bei großen Strohmengen darauf angewiesen, dass sich der pH- Wert im Optimalbereich befindet, da sonst Auflaufschäden durch noch nicht zersetztes Stroh auftreten können. Bei pH-Werten unter pH 5,5 erfolgt keine Bildung von wertvollen Humusformen mehr.

Kalk und Humus verbessert Bodenstruktur
Eine gute Bodenstruktur gehört zu den wichtigsten Bodeneigenschaften. Die Bodenstruktur, auch als Bodengefüge bezeichnet, beschreibt die räumliche Anordnung der festen Bodenbestandteile (Tonteilchen) zu den Hohlräumen, die mit Luft und Wasser gefüllt sind. Entscheidend für die Bodenstruktur (Krümelbildung) ist sowohl die Kalk- als auch die Humusversorgung des Bodens.
Bei der Strukturbildung dient das Calcium bzw. Magnesium als Kittsubstanz für eine stabile Krümelbildung. Der Kalk ist deshalb in erster Linie ein Bodendünger.
Auf schweren sowie verdichteten Böden erfolgt eine Kalkdüngung vorrangig zur Verbesserung der Bodenstruktur. Sie schützt den Boden auch vor Verschlämmung und Erosion.
Ton-Humus-Komplex – Calcium bildet die Brücke
Als Ton-Humus-Komplex wird die Aggregatbildung zwischen Humusstoffen und anorganischen Bestandteilen (Tonmineralien) bezeichnet. Die zweiwertigen Ca- bzw. Mg-Ionen bilden die Brücke zwischen Ton und Humus.

Neutralisationswert (NW) von Düngekalken

Für eine sachgerechte Durchführung der Kalkdüngung in der Pflanzenproduktion ist die Bewertung der Neutralisationswirkung von Düngekalken von besonderer Bedeutung. Die erfolgt grundsätzlich nach dem Gehalt an basisch wirksamen Bestandteilen als CaO (VDLUFA-Standpunkt).
Nach den Gesetzen der Chemie hat das Magnesium eine wesentliche stärkere Neutralisationswirkung und somit einen größeren Aufkalkungseffekt als die entsprechende Calciumverbindung.
Je größer der Anteil an Magnesium in einem Kalk, desto größer der Neutralisationswert.
Daher ist es von Vorteil, bei der Kalkung auf Böden mit Magnesiummangel, einen magnesiumreichen Kalk, wie z. B. kohlensauren Magnesiumkalk, zu verwenden.
Praxisbeispiel: Kalkbedarf 1.500 kg CaO/ha.
Kohlensaurer Kalk 85, 85 % CaCO3 mit NW 48 = 1500/48 = 31 dt/ha.
Kohlensaurer Magnesiumkalk 85, 50 % CaCO3 + 35 % MgCO3 mit NW 51 = 1500/51 = 29 dt/ha.
ERSPARNIS durch höheren NW = 2 dt/ha.
Für Details bitte in der Grafik klicken!